苏美尔管理咨询专业老师将为您解读转版具体工作:
一、新版标准有哪些变化?
ISO13485:2016生命周期的主题已经引入,贯穿产品设计开发,生产,储存,安装和处置的每个阶段,风险管理得到加强, 许多监管要求已被纳入。
以下是ISO13485:2016的主要修订和变化,可作为贵公司进行ISO13485:2016转换的参考:
1. 范围清楚地解释到其适用于产品的存储和分配,内部和外部供应商服务,以及相关服务,例如: 设备分销商,运输服务,灭菌服务,安装维护服务,软硬件配件供应商。
2. 删减条款更为合理。
新版延伸了不适用的条款,允许客户在有合理原因下删减第6,7或8条。 这种变化符合当前的业务发展模式,反映了标准的适用性。
3. 术语和定义更贴近实际。
条款已经被添加及修改。 2003版的定义已经被修改和删除。 新版本包括临床评估,生命周期,制造商,进口商,分销商,授权代表,绩效评估,投诉,上市后的监控,风险和风险管理等新技术术语。
4. 条款变更的更为合理。
新版本更多地考虑到监管的要求,并强调需遵守监管要求,以确保医疗设备的安全性和有效性。
许多监管要求已被采纳,如美国的FDAQSR820,日本的JPAL MO No.169,巴西GMP,EU-MDR和EU-IVDR以及加拿大,澳大利亚和中国的监管要求,使其具有更广泛适用性。
例如,介绍了可用性和软件应用要求; 控制设计过程更为详细; 明确规定了变更控制的要求; 加强对供应商管理的要求; 定义了可追溯性(UDI)的要求和目的; 添加了反馈和投诉处理的要求。
5. 风险管理的要求得到加强,新版本更加明确。
许多地方都提到“风险”和“风险管理”。 提出对供应商风险的控制。医疗器械风险,反馈机制,投诉处理和数据分析更为详细,从而使得上市后的风险监控系统更加可操作。
二、ISO13485:2016标准转换安排
为了响应UKAS的转版要求,确保认证客户可以顺利转版,第三方认证机构作出以下安排:
1)转版过渡期:
新标准的转版过渡期为3年(自ISO13485:2016的发布之日2016年3月1日起)
3)转版时机:
▶ 再认证转换
在再认证审核时进行全面转换。建议客户利用这个机会进行标准审核,因为它将在三年的审核周期中最大限度地减少额外的审核时间。
▶ 监督转换
在现有监督审核时进行全面转换; 审核活动将增加额外的时间,以便有时间根据新标准完成完整审核。转版审核的时间应至少等于再认证的时间。
▶ 特殊的访问转换
作为基于独立访问所进行的特别审核(不在客户正常的年度审核中),特殊审核的时间应至少等于再认证的时间。
▶ 无论客户选择实施何种标准转换的方式,所有客户的最低转版审核时间
不得低于再认证审核时间。另外根据产品的风险等级,额外增加客户的审核人天。
3)认证证书有效期:
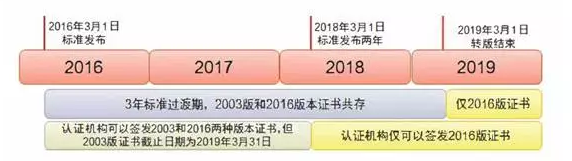
3.1 ISO13485:2003和BS EN ISO13485:2012版认证证书
有效截止日期为
2019年3月31日。
3.2 自
2019年 3月 31日(标准正式发布 3年后的日期)起,现有的ISO13485:2003和BS EN ISO13485:2012版的认证证书均
不再有效,未按时完成标准转换的企业,原证书失效,再申请时需按初审认证。
3.3 IAF明确在ISO 13485:2016版标准发布两年后,所有的新认证及再认证必须是基于 ISO 13485:2016。也就是说,第三方认证机构自
2018年3月1日起将
不再签发依据 ISO13485:2003和 BS EN ISO13485:2012标准的初审/再认证证书。
3.4 无论客户选择实施何种标准转换的方式,第三方认证机构将在通过转版审核后发布新三年的有效证书。
三、获证客户的转换工作准备
1) 企业应尽早进行准备,为后续标准转换提供宽裕的时间;
2) 组织标准培训,理解新版标准变化与要求,识别现行体系与新版标准要求的差距,对于其中的技术要求要深入理解,并结合在企业内部应用情况进行分析;
3) 企业应制定标准转换实施计划;
4) 企业应针对体系相关部门进行全面有效的培训;
5) 按照新版标准更新现有管理体系,修订和完善管理体系文件,并予以实施。新版标准的所有特定要求在企业内得到实施,并保存了相应的记录;
6) 至少针对体系标准转换进行一次内部审核和管理评审,评估管理体系是否满足ISO13485:2016标准要求,是否已做好 ISO1348:2016标准转换认证的准备,如果有不符合要求的应采取纠正预防措施,直至差距关闭;
7) 尽早联系联系我们,商榷转版审核的具体安排。
四、转版审核实施
1)企业完成标准转换准备工作后,中国大陆地区的客户需要提交ISO13485:2016标准转换申请书,海外客户需要提交Medical Device Management Systems Quote Request Form。
所有的客户均需要提交ISO13485:2016客户转换检查表,第三方认证机构将根据新版标准的要求对企业实施标准转换认证审核,重点关注企业是否识别了新版标准要求,并按 ISO13485:2016标准要求对管理体系实施了变更,新版标准管理体系运行情况,以及实施的有效性。
2)通过标准转换审核确认企业已符合新版标准要求后,并且确认企业对现场审核提出的问题已解决,推荐换发认证证书。
同时第三方认证机构将安排具有专业能力的认证决定人员对审核的资料进行评定,通过评定审核过程和审核组的推荐意见、以及其他方面得到的信息,批准后为企业换发新版标准证书。
五、对同时申请ISO9000和ISO13485认证的客户管理
1)对同时申请ISO9000和ISO13485申请认证的客户,第三方认证机构从认证申请,合同评审,审核方案策划(包括审核时间的确定和审核组的派遣),审核实施,认证决定整个认证过程进行系统管理。
2)ISO13485:2016与ISO9001:2008的条款架构是一致的,然而ISO9001:2015是一个新版架构,因此ISO13485:2003与ISO9001:2008可以一体化审核,但ISO13485:2016与ISO9001:2015不能一体化审核,这种新版架构的不兼容性将会导致人日的增加。
3)对于持有ISO 9001和ISO13485的认证的客户来讲,将意味着客户申请ISO9001:2015和ISO13485:2016转版审核时,审核人日在规定的基础上不可以进行减少。第三方认证机构将与客户沟通认证相关的关键因素,包括活动范围、复杂性和员工数量等,并确定最终的转换审核时间。
关于 ISO13485:2016转版的更多信息,请及时关注苏美尔管理咨询官方网站:
www.sumerchinea.com.cn;
或致电苏美尔管理咨询的工作人员随时为您提供有关标准转换过程的疑问。
联系人:周秋燕15962640146 李老师15995659146
联系电话:0512-36692745
E-mail:1807505361@qq.com sumer_kunshan@sina.com

